beneficios y riesgos de los alcoholes
METANOL
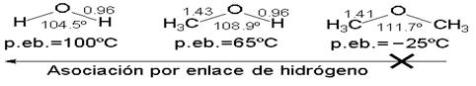
El alcohol de madera, alcohol metílico o metanol, de fórmula CH3OH, es el más simple de los alcoholes. Antes se preparaba por destilación destructiva de la madera, pero hoy en día casi todo el metanol producido es de origen sintético, elaborado a partir de hidrógeno y monóxido de carbono. El metanol se utiliza para desnaturalizar alcohol etílico, como anticongelante, disolvente para gomas y lacas, así como en la síntesis de compuestos orgánicos como el metanal (formaldehído). Al ser ingerido en forma líquida o inhalado en vapor, el metanol puede resultar peligroso. Tiene un punto de fusión de
-97,8 °C y un punto de ebullición de 64,7 °C. Su densidad relativa es de 0,7915 a 20 °C.
ETANOL
El alcohol de vino, alcohol etílico o etanol, de fórmula C2H5OH, es un líquido transparente e incoloro, con sabor a quemado y un olor agradable característico. Es el alcohol que se encuentra en bebidas como la cerveza, el vino y el brandy. Debido a su bajo punto de congelación, ha sido empleado como fluido en termómetros para medir temperaturas inferiores al punto de congelación del mercurio, -40°C, y como anticongelante en radiadores de automóviles.
Normalmente el etanol se concentra por destilación de disoluciones diluidas. El de uso comercial contiene un 95% en volumen de etanol y un 5% de agua. Ciertos agentes deshidratantes extraen el agua residual y producen etanol absoluto. El etanol tiene un punto de fusión de -114,1 °C, un punto de ebullición de 78,5 °C y una densidad relativa de 0,789 a 20 °C.
Desde la antigüedad, el etanol se ha obtenido por fermentación de azúcares. Todas las bebidas con etanol y casi la mitad del etanol industrial aún se fabrican mediante este proceso. El almidón de la patata (papa), del maíz y de otros cereales constituye una excelente materia prima. La enzima de la levadura, la cimasa, transforma el azúcar simple en dióxido de carbono. La reacción de la fermentación, representada por la ecuación
C6H12O6 ! 2C2 H5OH + 2CO2
Es realmente compleja, ya que los cultivos impuros de levaduras producen una amplia gama de otras sustancias, como el aceite de fusel, la glicerina y diversos ácidos orgánicos. El líquido fermentado, que contiene de un 7 a un 12% de etanol, se concentra hasta llegar a un 95% mediante una serie de destilaciones. En la elaboración de ciertas bebidas como el whisky y el brandy, algunas de sus impurezas son las encargadas de darle su característico sabor final. La mayoría del etanol no destinado al consumo humano se prepara sintéticamente, tanto a partir del etanal (acetaldehído) procedente del etino (acetileno), como del eteno del petróleo. También se elabora en pequeñas cantidades a partir de la pulpa de madera.
La oxidación del etanol produce etanal que a su vez se oxida a ácido etanoico. Al deshidratarse, el etanol forma dietiléter. El butadieno, utilizado en la fabricación de caucho sintético, y el cloroetano, un anestésico local, son otros de los numerosos productos químicos que se obtienen del etanol. Este alcohol es miscible (mezclable) con agua y con la mayor parte de los disolventes orgánicos. Es un disolvente eficaz de un gran número de sustancias, y se utiliza en la elaboración de perfumes, lacas, celuloides y explosivos. Las disoluciones alcohólicas de sustancias no volátiles se denominan tinturas. Si la disolución es volátil recibe el nombre de espíritu.
ALCOHOLES SUPERIORES
Los alcoholes superiores, de mayor masa molecular que el etanol, tienen diversas aplicaciones tanto específicas como generales: el propanol se usa como alcohol para frotar y el butanol como base para perfumes y fijadores. Otros constituyen importantes condimentos y perfumes.
Etanol:
Metanol
En la antigüedad el Metanol se obtenía por destilación seca de la madera. Actualmente se prepara en grandes cantidades por catalítica del monóxido de carbono:
Co + H2 H-CH2-OH
)El Metanol no se utiliza en bebidas Alcohólicas, debido a su poder de Toxicidad.
El Alcohol Etílico es el apropiado para la fabricación de bebidas alcohólicas., Con el fin de que no sirva para la preparación de bebidas.
Se prepara industrialmente por diversos métodos:
a) Partiendo del etileno (del craqueo del petróleo) por vapor a presión, en presencia de un catalizador:
C2H4 + H2O C2H5-OH
b) A Partir del Acetileno, por hidratación en presencia de sales mercúricas, dando un aldehído posteriormente se reduce por el hidrógeno, en presencia de níquel finamente dividido que actúa como catalizador.
c) Se obtiene en grandes cantidades por fermentación de líquidos azucarados. Su obtención se basa en que la glucosa (un azúcar de formula: C6H12O6) fermenta por la acción de un enzima producido por un grupo de hongos microscópicos, sacaromicetos (levadura de cerveza), dando alcohol y anhídrido Carbónico.
Para la obtención industrial del alcohol seria demasiado cara la glucosa como materia prima. Por esto se parte de las mezclas del azúcar de caña o de remolacha o de otros materiales ricos en almidón, papas o semillas de gramíneas.
d) El almidón se transforma por la acción de una enzima en maltosa, que a su vez por otra acción enzimática, se desdobla en dos moléculas de glucosa.
ð El metanol es tóxico tanto como líquido o como vapor. Puede ingresar al organismo por la nariz, la boca o la piel (especialmente por vía de cortes o lastimaduras) y es rápidamente absorbido por los fluidos del cuerpo.
EFECTOS DE ALGUNOS ALCOHOLES AL ENTRAR EN CONTACTO CON EL CUERPO HUMANO.
ALCOHOL ETÍLICO (ETANOL).
El alcohol se absorbe en estómago (un 20% en ayuno) y el máximo en sangre aparece a los 40-45 minutos. La comida retarda la absorción en el tubo digestivo. El alcohol tarda de 10-30 horas en desaparecer de la sangre.
El metabolismo es:
Alcohol alcohol deshidrogenasas acetaldehído.
Acetaldehído alcohol deshidrogenasa ácido acético.
La sintomatología a dosis elevadas y repetidas es de hepatotóxico y neurotóxico potente.
1. Sedación, distensión psíquica.
2. Euforia.
3. Alteración de la sensación dolorosa.
4. Alteración de la coordinación muscular.
5. Narcosis.
6. Hiperventilación.
7. Sensación de angustia.
8. Pérdida de reflejos.
9. Parálisis de la respiración y muerte muy difícil porque provoca vómito.
El etanol es uno de los productos que más contraindicaciones tiene.
METANOL
Es alcohol de quemar. Suele ser azul por el colorante que le añaden.
Es más tóxico en humanos y primates que en otras especies animales. Se han reportado también casos letales por exposición dérmica e inhalatoria.
El MeOH es oxidado en el hígado a formaldehído (por la alcohol deshidrogenasa en primates y catalasa peroxidasa en roedores). Después pasa a ácido fórmico (por la formaldehído deshidrogenasa) en mamíferos no primates. El ácido fórmico pasa a CO2 y H2O.
En humanos, la ingestión de 0'15 ml / kg de metanol puro puede causar una intoxicación borrachera, acidosis metabólica a las 8-12 horas y posible ceguera temporal o permanente.
Se debe hacer emesis, lavado gástrico, carbón activo y corrección de la acidosis para evitar que continúe.
Actuando la alcohol deshidrogenasa se da etanol, 4-metilpirazol (inhibidor de la alcohol deshidrogenasa).
Antes se usaba para ayudar a llegar a cierto grado de alcohol en bebidas.
ETILENGLICOL
Su mecanismo de acción consiste en la formación de ácidos oxálicos que se combinan con Ca2+ y cristaliza en capilares y túbulos renales.
La sintomatología tiene dos fases. La primera fase produce vómitos, depresión nerviosa, ataxia, taquipnea, hipotermia y acidosis.
La segunda fase produce una insuficiencia renal.
Los cristales son birrefringentes y se puede detectar por eso.
El tratamiento consiste en un lavado gástrico, carbón activo, catártico salino, pentobarbital sódico, prednisona, bicarbonato de sodio IV, etanol (no siempre recomendable), 4-metilpirazol (antídoto de elección).
DISOLVENTES Y SUSTANCIAS AFINES
Productos usados preferentemente como disolventes o como diluyentes, pero también como compuestos de partida para la síntesis de otros productos combustibles, anticoagulantes, aromatizantes, bebidas, fármacos...
Hidrocarburos alifáticos pentano, hexano (muy tóxico porque se metaboliza en 2,3-hexanodiona neurotóxico muy potente), heptano, octano, etilén, acetileno...
Hidrocarburos alicíclicos ciclopropano, ciclohexano (muy tóxico porque se metaboliza en 2,3-hexanodiona neurotóxico muy potente)...
Hidrocarburos aromáticos benceno (anillo principal aromático, es carcinógeno, lo lleva más la gasolina sin plomo), tolueno, xileno...
Hidrocarburos halogenados cloroformo, tricloroetileno, tetracloruro de C (disolvente de productos en seco), halotano, enfluorane (muy buenos disolventes pero muy problemáticos).
Cetonas acetona.
Éter éter dietílico (buen disolvente y anestésico). Muy explosivo. Punto de ebullición de 35ºC.
Alcoholes metanol, etanol, n-propanol, isopropanol, etilenglicol, fenol...
Aldehídos formaldehído, acetaldehído...
Nitrilos acetonitrilo...
ALQUITRÁN
Muy variable. 50% betún y 50% otros compuestos como el benceno, tolueno, xilenos, naftalenos, fenoles, cresoles y amoniacos.
Les gusta mucho a los cerdos. También a los gatos (muy susceptible para la glucoronoconjugación).
La sintomatología que produce es anorexia, depresión, debilidad, ictericia, taquipnea y muerte.
Los esnifadores de cola usaban el benceno y, ahora, el tolueno.
FENOLES Y CRESOLES
Usados como desinfectantes, ungüentos, preservación de la madera (palos de electricidad y teléfonos, traviesas de la vía...).
Afecta a gatos principalmente.
La sintomatología es depresión, vómitos, incoordinación, convulsiones, coma y muerte.
El tratamiento consiste en emesis o lavado gástrico, glucosa salina IV, estimulantes del sistema nervioso...
Tiene mal pronóstico.
HIDROCARBUROS AROMÁTICOS POLICÍCLICOS
Sobre todo se forman en la combustión de materia orgánica, volcanes, incendios forestales, alimentos ahumados o alimentos sometidos a altas temperaturas, motores de combustión interna, tabaco (sobre todo benzopireno).
Necesitan la activación metabólica.
Son carcinógenos.
No es recomendable basar la dieta en estos productos.
DAÑOS AL CUERPO
Inhalación: Altas concentraciones de vapores de metanol pueden causar la muerte.
El primer síntoma de envenenamiento con Metanol es la ceguera ya que daña el nervio óptico.
El Etanol, es la droga más antigua usada por el hombre, es una de las drogas que provoca mas dependencia afectando principalmente al hígado. El Alcohólico sufre una variación biológica cualitativa de la respuesta del sistema nervioso.
Sistema Digestivo: Irrita la mucosa del esófago, el estomago, y el intestino cuyas funciones digestivas altera. También puede originar diarrea crónica y cirrosis hepática, enfermedad en la cual el tejido normal del hígado es reemplazado por cicatrices fibrosas que impiden el cumplimiento de las importantes funciones de este órgano.
Sistema Respiratorio: Causa neumonías, abscesos pulmonares.
Sistema Circulatorio: produce insuficiencia cardiaca, alteraciones del ritmo de sus latidos, agrandamiento del corazón e hipertensión. Disminuye la actividad de los leucocitos y la resistencia de las enfermedades.
Sistema Muscular: origina inflamaciones y calambres.
Sistema Nervioso: provoca desinhibiciones, lentitud en los reflejos, incoordinación muscular, dificultades en la memoria, desorientación en el tiempo y espacio. Además ocasiona modificaciones en el carácter, con periodos de tristeza, de pereza, de irritabilidad y de violencia, pesadillas, alucinaciones nocturnas especialmente relacionadas con precipicios y con animales, monstruos que lo atacan.
En la piel: causa dilatación capilar y le da un color rojo oscuro y un aspecto rugoso en la cara, especialmente en la nariz.
En la visión: la alcoholemia excesiva estecla el campo visual, que normalmente es de uno 180º. Provoca así la “visión túnel” que impide al conductor percibir los vehículos las personas que se aproximen a ambos lados trasversales.
El Metanol, se utiliza como disolvente, anticongelante, desnaturalizante del “alcohol de quemar” y para la fabricaron de barnices, plásticos, y otros compuestos orgánicos. Hace un tiempo se experimento que con dosis muy pequeñas de Metanol disueltas en agua se obtiene muchos beneficios en plantas de clasificación C3 y en condiciones de cálidas y soleadas. Esta solución facilitaba el crecimiento de cosechas más frecuentes y mayores, minimizaba el uso de agua en el riego y una reducción en el uso de plaguicidas
El Etanol, además de utilizarse para la producción de bebidas alcohólicas, su fin esta destinado a el uso industrial y se emplea como disolvente en farmacia, perfumería y en compuestos orgánicos.
El Propanol, se utiliza como un antiséptico aún más eficaz que el alcohol etílico; es usado como un disolvente importante, su uso ams común es en forma de quitaesmalte. Además se utiliza como desnaturalizante, generalmente mezclado con otros compuestos.
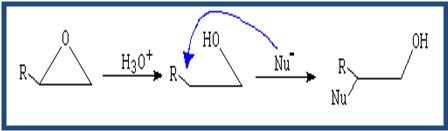
beneficios y riesgos de los éteres
Aplicaciones Generales
Anestésico general.
Medio extractar para concentrar ácido acético y otros ácidos.
Medio de reacción en la síntesis WURTZ y de GRIGNARD.
Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
Combustible inicial de motores Diesel.
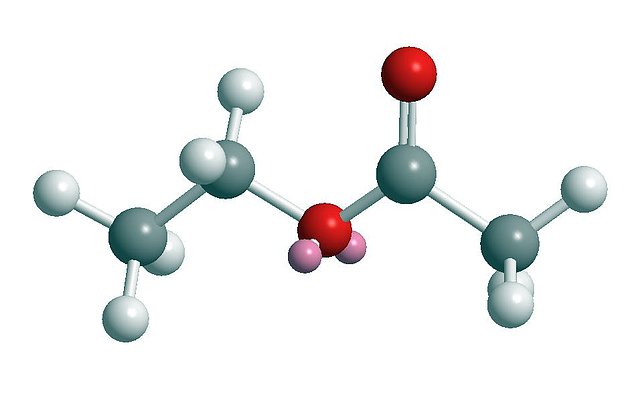
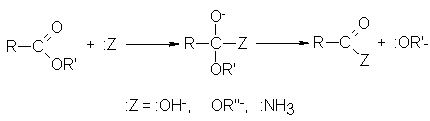
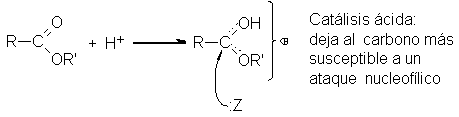
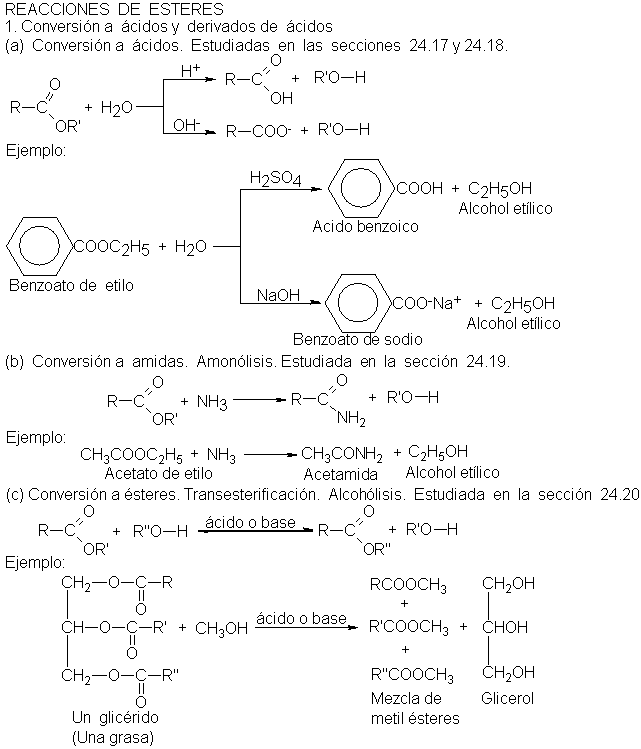
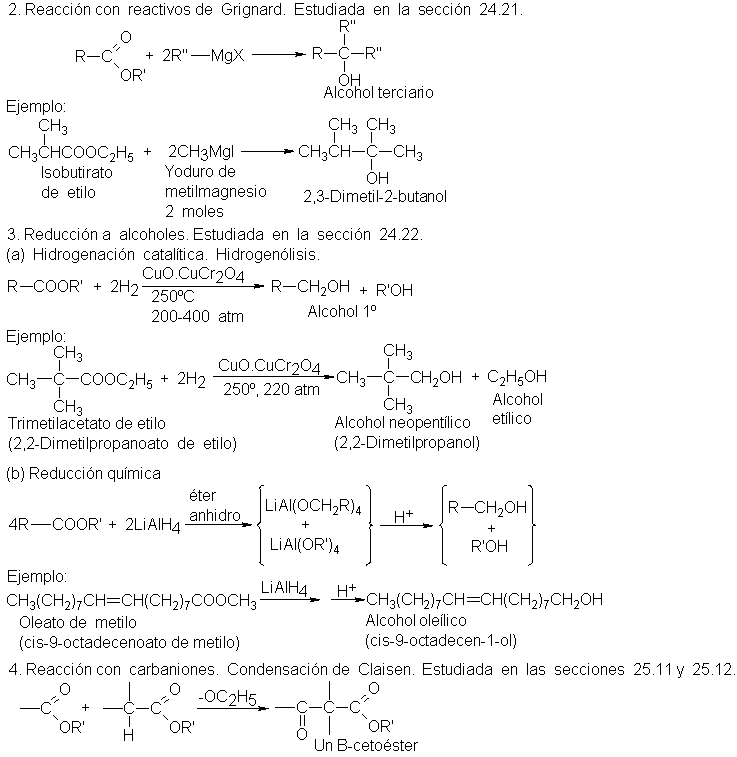
beneficios y riesgos de los ésteres
cuando se utilizan sin las precauciones adecuadas, el conocimiento previo
de los riesgos que conlleva su utilización, así como un sistema eficaz de
seguridad y salud constituyen la mejor prevención y protección de los trabajadores frente a éstos riesgos.